Différences entre versions de « Biofilm »
Sauter à la navigation
Sauter à la recherche
| Ligne 170 : | Ligne 170 : | ||
* Supprimer les surface d'adhérences du biofilm | * Supprimer les surface d'adhérences du biofilm | ||
| − | ::- tissus dévitalisés : nécrose , fibrine, hématome | + | ::- tissus dévitalisés : [[nécrose]] , fibrine, hématome |
::- corps étranger: os, tendon, calcification, matériel prothétique, débris de pansements | ::- corps étranger: os, tendon, calcification, matériel prothétique, débris de pansements | ||
Version du 2 avril 2020 à 13:05
Les Biofilms sont des communautés bactériennes qui colonisent les plaies chroniques et impactent le processus de cicatrisation
Généralités
- A la surface d'une plaie, les micro-organismes existent et vivent librement, individuellement et solitaires: on parle de bactéries planctoniques.
- Mais il existe un autre mode de vie bactérienne: les biofilms
- Un biofilm est une communauté structurée de bactéries, enrobée d'une matrice polymérique et attachée à une surface . Le biofilm protège les bactéries et leur permet de vivre dans un environnement hostile en résistant aux traitements et à la réponse immunitaire de l'hôte.
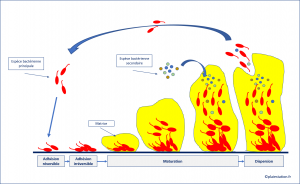
Comment se forme un biofilm ?
- Un biofilm peut se former en quelques heures selon des étapes définies.
Adhésion
Phase d'adhérence réversible
- Les bactéries planctoniques ( flottantes) vont, dans certaines conditions, adhérer à une surface qui peut être un tissu vivant ou une surface inerte (un cathéter, une prothèse ou autre implant).
- Cette adhésion se produit sous l'influence de structures ou de molécules propres à la surface de la bactérie.
- Cette phase initiale est réversible sous l'influence du traitement local ou des défenses immunitaire de l'hôte.
Adhésion permanente et irréversible à la surface
- Les différentes bactéries qui adhèrent à la surface vont créer des liens plus solides entre elles, et ces micro colonies forment un biofilm immature.
- Ces colonies sont accrochées de façon irréversible à leur surface d'adhérence : on parle de bactéries sessiles.
Maturation
Sécrétion de la matrice
- Une fois qu'elles sont fermement attachées à la surface , les bactéries sécrètent une matrice polymérique qui les protège et les isole du milieu extérieur.
- La matrice est essentiellement composée d'eau à 97% . Le reste de sa composition varie en fonction de l'espèce bactérienne prédominante dans le biofilm.
Quorum sensing
- Les bactéries dans le biofilm utilisent un système de communication basé sur la sécrétion et la perception de petites molécules appelées autoinducteurs.
- Ces molécules permettent à la communauté bactérienne d'adapter son comportement en fonction de la taille de la communauté.
Biofilm mature
- Ces biofilms sont donc composés d'une ou plusieurs espèces bactérienne englobées dans cette matrice protectrice
- Il s'agit de structures dynamiques qui se modifient en permanence .
Détachement
- L'étape finale est le détachement et la dispersion des bactéries sessiles du biofilm. Le détachement peut être initié par des forces mécaniques ( détersion dans le cas des plaies) , une dégradation enzymatique de la matrice ou de surface d'adhésion, l'utilisation d'agent tensio-actifs ( surfactants).
- Les bactéries sessiles ainsi libérées vont pouvoir créer un nouveau biofilm , ou s'intégrer dans un biofilm déjà existant.
- Après fragmentation, le biofilm peut se reformer de façon mature et résistant dans un délais de 24 à 72 heures. heurs. Ce délai permet de comprendre qu'après un geste de détersion sur une plaie colonisée par un biofilm, il faille utiliser un traitement spécifique (pansement ou technique de soin) pour détruire les bactéries avant reformation du biofilm.
Résistance des biofilms
- Les biofilms ont la capacité à survivre dans un environnement hostile et les bactéries d'un biofilm sont moins sensibles aux antibiotiques , aux antiseptiques et à la réponse immunitaire que les mèmes bactéries dans une forme planctonique.
- On parle d'un phénomène de Tolérance des biofilms. Ses mécanismes sont multiples
Effet barrière de la matrice
- Cet effet provoque une diminution de la pénétration et/ou e la diffusion des antibiotiques .
- Certains antibiotiques pénètrent facilement dans la matrice, mais la diminution de diffusion expose les bactéries à des concentrations sub-inhibitrices, à l'origine d'une adaptation physiologique des bactéries et la sélection de mutants.
Altération du micro-environnement
- Il existe une variation de la composition du milieu matriciel. Ainsi, les couches profondes du biofilm sont caractérisées par une diminution des concentrations en oxygène, en nutriments et par une accumulation de déchets produits par les bactéries.
- Les bactéries de ces couches profondes se multiplies peu et sont moins sensibles à certains antibiotiques.
Mécanismes génétiques
- Ils s'agit de gène d'expression spécifique qui modifierait le comportement des bactéries vis à vis des antibiotiques.
Cellules persistantes
- IL s'agit d'une population minoritaire au sein du biofilm et qui ont pour particularité d'être capables de survivre dans des concentrations élevées d'antibiotiques.
- La notion de "persistance" n'est pas une résistance . Ces bactéries sont génétiquement identiques aux autres, il ne s'agit donc pas d'une mutation, mais d'un mode de fonctionnement spécifique. Ces cellules sont en état de "dormance".
- Ces cellules peristantes sont capables de reproduire le biofilm si un traitement antibiotique a détruit les cellules "non peristantes", et cet élément peut expliquer, en partie , la "résistance" du biofilm aux traitement et les infections récidivantes.
Biofilm et plaies chroniques
Prévalence du biofilm dans les plaies chroniques
- Le micro environnement des plaies chroniques avec des débris nécrotiques, des exsudats, une diminution de la pression d'oxygène et une diminution de la réponse immune de l'hôte sont des conditions favorables pour la croissance bactérienne.
- La prévalence exacte d'un biofilm sur les plaies chroniques reste cependant incertaine en raison des critères d'inclusions et des modalités de prélèvement.
- L'étude initiale de James en 2008 retrouvait la présence de biofilm dans 60% des plaies chroniques analysées contre 6% seulement dans les cas de plaies aiguës.[1]
- D'autres études évoquent la présence quasi systématique de biofilm sur les plaies chroniques. [2] [3] [4]
- L'étude de prévalence est d'autant plus difficile qu'il n'y a pas de "test standard" ou de biomarqueurs spécifiques pour diagnostiquer la présence biofilm sur une plaie chronique
Diagnostic du biofilm sur une plaie chronique
Impact des biofilms sur la cicatrisation
Inflammation chronique
- La présence d'un biofilm sur une plaie à un impact négatif sur le processus de cicatrisation en provoquant et entretenant un état inflammatoire chronique à la surface de cette plaie.
- L'inflammation est marquée par
- - une augmentation des cellules inflammatoires : polynucléaires, macrophages
- - une augmentation des cytokines inflammatoires ( TNFα, IL1β, IL6 ), qui vont en retour majorer recrutement de cellules inflammatoire et donc de l'inflammation.
- - une augmentation des protéases : métalloprotéases matricielles, élastase
- L'ensemble de ces anomalies biologiques à la surface d'une plaie chronique provoque
- - une destruction des protéines de la matrice extra cellulaire et donc un destruction du tissu de gtanulation
- - une destruction des facteurs de croissance et notamment de PDGF ( Platelt Derived Growth Factor)
- - Une destruction des récepteurs membranaires pour les facteurs de croissance.
- Le biofilm n'est pas seul responsable de l'inflammation chronique, d'autres facteurs liés à l'hôte sont également en cause:
- - des facteurs d'hypoxie : anémie , artériopathie, œdème, tabagisme
- - des facteurs d'immunodépression: immunodépression acquise, dénutrition, diabète
- Ce dernier point est fondamental. La prise en charge de ces facteurs de risque doit être associé à la prise en charge local du biofilm pour permettre d'évoluer vers la cicatrisation d'une plaie chronique .
Faible pression d'oxygène
- Cf article du wuwhs
Prise en charge du biofilm à la surface d'une plaie chronique
Généralités
- Quatre axes de prise en charge devant un biofilm
| Provoquer la dispersion | Éviter la colonisation | Éviter la phase d'attachement irréversible | Éliminer les bactéries sessiles |
|---|
- Un biofilm doit être pris en charge de façon rapide et "agressive" pour être efficace rapidement et limiter le risque de chronicité
- Cette prise en charge est évidemment rendue difficile par les difficultés de diagnostic
Détersion
Objectifs
- Détacher les bactéries sessiles de la surface d'adhérence
- Provoquer la dispersion du biofilm
- Supprimer les surface d'adhérences du biofilm
- - tissus dévitalisés : nécrose , fibrine, hématome
- - corps étranger: os, tendon, calcification, matériel prothétique, débris de pansements
Lavage et hygiène de la plaie
- Le lavage à l'eau et au savon reste un élément indispensable même s'il ne s'agit pas à proprement parler d'un acte de détersion.[5]
- On peut s'aider de solution de surfactant Ces produits tensio-actifs réduisent la tension superficielle entre un liquide et un solide et aide à l'élimination des tissus dévitalisés, des corps étranger et des bactéries planctoniques
Moyens de détersion
- Aucun moyens de détersion ne peut être privilégié par rapport à autre.
- Le mode de détersion doit être évalué en fonction
- - de l'étiologie et d'éventuelles contre-indications à une détersion mécanique.
- - à la douleur induite
- - à la présence de corps étrangers qui peuvent justifier une détersion chirurgicale ( os/ tendon / prothèse)
- - à l'état de la peau péri lésionnelle: une détersion en milieu humide sera évitée en cas de macération de la peau périphérique
En pratique
- La détersion d'une plaie colonisée avec un biofilm est indispensable.
- Elle doit être faite de façon quotidienne puisque de le cycle de production du biofilm est d'environ 24 heures .
- La détersion doit être efficace. Il convient donc de trouver le meilleur moyen, éventuellement avec l'aide d'une équipe spécialisée pour bénéficier de techniques hospitalière ( détersion chirurgicale, Thérapie à Pression Négative, Larves, électrostimulation)
- Elle doit être rapidement efficace
Évitez la colonisation
- Hygiène / Stérilité des soins
- Limiter la présence de surface d'attache > détersion des tissus dévitalisés et des corps étrangers ( os / tendon / calcification / matériel prothétique, débris de pansement...).
Évitez la phase d'attachement irréversible
- Traitement anti quorum sensing.
Éliminer les bactéries sessiles
- Détersion
- Anti microbiens → antiseptiques
- Surfactants
- Autres: peptides anti microbiens / extraits végétaux ( ail, cranberry...) / miel / huiles essentielles
Prise en charge spécifique du biofilm des plaies chroniques: ici
Références
- ↑ James GA, Swogger E, Wolcott R, Pulcini Ed, Secor P, Sestrich J, Costerton JW, Stewart PS. Biofilms in chronic wounds. Wound Repair Regen. 2008;16:37-44.
- ↑ Wolcott RD, Rhoads DD, Bennett ME, Wolcott BM, Gogokhia L, Costerton JW, Dowd SE. Chronic wounds and the medical biofilm paradigm. J Wound Care. 2010;19(2):45-6, 48-50, 52-3.
- ↑ Metcalf DG, Bowler PG. Clinician perceptions of wound biofilm. Int Wound J. 2014;8. doi: 10.1111/iwj.12358.
- ↑ Malone M, Bjarnsholt T, McBain AJ et al. The prevalence of biofilms in chronic wounds: a systematic review and meta-analysis of published data. Journal of Wound Care 2017 26(1):20–5
- ↑ Bellingeri A et al. Effect of a wound cleansing solution on wound bed preparation and inflammation in chronic Wounds: a single-blind RCT. J Wound Care 2016; 25: 3, 160–168.