Biofilm et Plaies chroniques
Révision datée du 7 novembre 2019 à 05:47 par Pascal Toussaint (discussion | contributions)
Les plaies chroniques sont très souvent colonisées par un Biofilm.
sont des communautés bactériennes qui colonisent les plaies chroniques et impactent le processus de cicatrisation
Généralités
Définition
- A la surface d'une plaie, les micro-organismes existent dans une forme libre, flottant dans le milieu : on parle de bactéries planctoniques. Mais il existe un autre mode de vie bactérienne: les biofilms.
- Un biofilm est une communauté structurée de bactéries, enrobée d'une matrice polymérique et attachée à une surface .
- Le biofilm protège les bactéries et leur permet de vivre dans un environnement hostile en résistant aux traitements antibiotiques, antiseptique et à la réponse immunitaire de l'hôte.
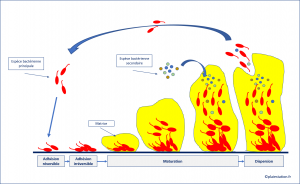
Formation d'un biofilm sur une plaie
Adhésion
- Les bactéries planctoniques adhèrent à une surface: tissu dévitalisé ( nécrose / fibrine / hématome) , sur un corps étranger ( os / tendon / calcification / mathériel prothétique) , ou sur le tissu de granulation. Cette adhésion au départ réversible devient progressivement irréversible. On parle alors de bactéries sessiles.
Maturation
- Pendant le phase de maturation, les bactéries sécrètent une matrice polymérique, composée à 97% d'eau, dans laquelle elles seront protégées.
- Pendant cette phase, les bactéries vont communiquer entre elle par le phénomène de Quorum sensing. Elles vont vont ainsi pouvoir adapter leur comportement en fonction de la taille de la communauté bactérienne
Dispersion
- La matrice peut se rompre sous l'effet de force mécanique ( détersion) , par une dégradation enzymatique, ou par l'utilisation de surfactant.
- Les bactéries libérées vont pouvoir aller former un nouveau biofilm ou s'intégrer dans un autre biofilm.
Cycle du biofilm
- Toutes ces étapes de la formation d'un biofilm dure 24 à 36 heures, ce qui explique la nécessité d'une prise en charge quotidienne pour éviter la re-formation du biofilm.
Résistance des biofilms
- Les biofilms ont la capacité à survivre dans un environnement hostile et les bactéries d'un biofilm sont moins sensibles aux antibiotiques , aux antiseptiques et à la réponse immunitaire.
- On parle d'un phénomène de Tolérance des biofilms qui est du à l'effet barrière de la matrice, à une modification de la composition chimique de la matrice, à des modifications génétiques des bactéries et enfin à la présence de cellules persistantes (bactéries "dormantes" qui résistent à de très hautes concentrations d'antibiotiques et qui expliquerait le caractère récidivant des infections) .
Les plaies chroniques sont elles colonisées par un biofilm ?
- Le micro environnement des plaies chroniques avec des débris nécrotiques, des exsudats, une diminution de la pression d'oxygène et une diminution de la réponse immune de l'hôte sont des conditions favorables pour la croissance bactérienne.
- La prévalence exacte d'un biofilm sur les plaies chroniques reste cependant incertaine en raison des critères d'inclusions et des modalités de prélèvement.
- L'étude initiale de James en 2008 retrouvait la présence de biofilm dans 60% des plaies chroniques analysées contre 6% seulement dans les cas de plaies aiguës.[1]
- D'autres études évoquent la présence quasi systématique de biofilm sur les plaies chroniques. [2] [3] [4]
Quel est l'impact du biofilm sur la plaies chroniques ?
Inflammation chronique
- Le biofilm entretient l’inflammation chronique avec la persistance de cellules inflammatoires ( polynucléaires neutrophiles, macrophages...), de cytokines inflammatoire et de protéases.
- L'inflammation est également liée à des facteurs liés à l'hôte: hypoxie, immunodépression, dénutrition.
Retard de cicatrisation
- L'inflammation provoque la destruction de la matrice extra cellulaire, la diminution des facteurs de croissance.
Risque d'infection
Comment faire le diagnostic du biofilm sur une plaie ?
- Le biofilm n'est pas seul responsable de l'inflammation chronique, d'autres facteurs liés à l'hôte sont également en cause:
- - des facteurs d'hypoxie : anémie , artériopathie, œdème, tabagisme
- - des facteurs d'immunodépression: immunodépression acquise, dénutrition, diabète
- Ce dernier point est fondamental. La prise en charge de ces facteurs de risque doit être associé à la prise en charge local du biofilm pour permettre d'évoluer vers la cicatrisation d'une plaie chronique .
Faible pression d'oxygène
- Cf article du wuwhs
Généralités
- Quatre axes de prise en charge devant un biofilm
| Provoquer la dispersion | Éviter la colonisation | Éviter la phase d'attachement irréversible | Éliminer les bactéries sessiles |
|---|
- Un biofilm doit être pris en charge de façon rapide et "agressive" pour être efficace rapidement et limiter le risque de chronicité
- Cette prise en charge est évidemment rendue difficile par les difficultés de diagnostic
Détersion
Objectifs
- Détacher les bactéries sessiles de la surface d'adhérence
- Provoquer la dispersion du biofilm
- Supprimer les surface d'adhérences du biofilm
- - tissus dévitalisés : nécrose , fibrine, hématome
- - corps étranger: os, tendon, calcification, matériel prothétique, débris de pansements
Lavage et hygiène de la plaie
- Le lavage à l'eau et au savon reste un élément indispensable même s'il ne s'agit pas à proprement parler d'un acte de détersion.[5]
- On peut s'aider de solution de surfactant Ces produits tensio-actifs réduisent la tension superficielle entre un liquide et un solide et aide à l'élimination des tissus dévitalisés, des corps étranger et des bactéries planctoniques
Moyens de détersion
- Aucun moyens de détersion ne peut être privilégié par rapport à autre.
- Le mode de détersion doit être évalué en fonction
- - de l'étiologie et d'éventuelles contre-indications à une détersion mécanique.
- - à la douleur induite
- - à la présence de corps étrangers qui peuvent justifier une détersion chirurgicale ( os/ tendon / prothèse)
- - à l'état de la peau péri lésionnelle: une détersion en milieu humide sera évitée en cas de macération de la peau périphérique
En pratique
- La détersion d'une plaie colonisée avec un biofilm est indispensable.
- Elle doit être faite de façon quotidienne puisque de le cycle de production du biofilm est d'environ 24 heures .
- La détersion doit être efficace. Il convient donc de trouver le meilleur moyen, éventuellement avec l'aide d'une équipe spécialisée pour bénéficier de techniques hospitalière ( détersion chirurgicale, Thérapie à Pression Négative, Larves, électrostimulation)
- Elle doit être rapidement efficace
Évitez la colonisation
- Hygiène / Stérilité des soins
- Limiter la présence de surface d'attache > détersion des tissus dévitalisés et des corps étrangers ( os / tendon / calcification / matériel prothétique, débris de pansement...).
Évitez la phase d'attachement irréversible
- Traitement anti quorum sensing.
Éliminer les bactéries sessiles
- Détersion
- Anti microbiens → antiseptiques
- Surfactants
- Autres: peptides anti microbiens / extraits végétaux ( ail, cranberry...) / miel / huiles essentielles
Prise en charge spécifique du biofilm des plaies chroniques: ici
Références
- ↑ James GA, Swogger E, Wolcott R, Pulcini Ed, Secor P, Sestrich J, Costerton JW, Stewart PS. Biofilms in chronic wounds. Wound Repair Regen. 2008;16:37-44.
- ↑ Wolcott RD, Rhoads DD, Bennett ME, Wolcott BM, Gogokhia L, Costerton JW, Dowd SE. Chronic wounds and the medical biofilm paradigm. J Wound Care. 2010;19(2):45-6, 48-50, 52-3.
- ↑ Metcalf DG, Bowler PG. Clinician perceptions of wound biofilm. Int Wound J. 2014;8. doi: 10.1111/iwj.12358.
- ↑ Malone M, Bjarnsholt T, McBain AJ et al. The prevalence of biofilms in chronic wounds: a systematic review and meta-analysis of published data. Journal of Wound Care 2017 26(1):20–5
- ↑ Bellingeri A et al. Effect of a wound cleansing solution on wound bed preparation and inflammation in chronic Wounds: a single-blind RCT. J Wound Care 2016; 25: 3, 160–168.