De PlaieXpertise - Base de connaissances
Sauter à la navigation
Sauter à la recherche
La Phase Inflammatoire de la cicatrisation est fondamentale dans la compréhension du mécanisme de cicatrisation et dans la genèse des plaies chroniques
Généralités
Cicatrisation et inflammation
- La cicatrisation est un processus complexe qui permet la réparation des lésions tissulaires
- La réponse inflammatoire ou l'inflammation joue un rôle essentiel dans ce processus physiologique
- L'inflammation est un mécanisme développé au cours de l'évolution pour adapter la réponse de l'hôte à une lésion tissulaire → elle est indispensable au rétablissement de l'homéostasie cutanée et de la cicatrisation des plaies.
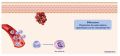
Acteurs de la phase inflammatoire
Cellules impliquées
| Plaquettes |
Polynucléaires neutrophiles |
macrophages |
Lymphocytes T
|
- La phase inflammatoire se caractérise par l’infiltration séquentielle des polynucléaires neutrophiles , des granulocytes, des monocytes/macrophages et des lymphocytes au niveau de la plaie
Protéines de l'inflammation
| Cytokines inflammatoires |
Texte de la cellule
|
| Cytokines anti-inflammatoires |
Texte de la cellule
|
| Facteurs de croissance |
Texte de la cellule
|
| Enzymes protéolytiques |
|
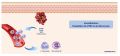
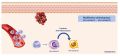
Réponse inflammatoire dans une plaie aiguë → Mise en jeu de l'immunité innée
- L’immunité innée constitue la première ligne de défense vis-à-vis du traumatisme cutané et des agents microbiens.
- La réponse immunitaire innée est déclenchée par les signaux d'alarmes → les signaux moléculaires libérés par les cellules et tissus altérés (DAMPS pour Damage Associated Molecular Patterns) et les signaux moléculaires liés aux bactéries (PAMPs pour Pathogen Associated Molécular Patterns)
- Ces DAMPs et ces PAMPs activent les cellules immunitaires résidentes normales de la peau → mastocytes, cellules de Langerhans, lymphocytes T et macrophages via des récepteurs
- Cette activation permet la libération de cytokines inflammatoires qui ont plusieurs objectifs
- - attirer les polynucléaires neutrophiles vers le lit de la plaie
- - favoriser une vasodilatation
- - permettre l'adhésion et la diapédèse des polynucléaires et des monocytes
Rôle des neutrophiles
- Les neutrophiles arrivent rapidement après le traumatisme cutané, grâce à l'action de plusieurs cytokines → Interleukine 1 (IL-1), Tumor Necrosis Factor α (TNF α), endotoxines bactériennes comme les Lipopolysaccharides (LPS)
- Les polynucléaires vont à leur tour relarguer des cytokines et vont permettre
- - la phagocytose des débris cellulaires et des tissus nécrotiques
- - la phagocytose des bactéries
- - le relargage de radicaux libres, d'enzymes protéolytiques et de peptides antimicrobiens
- La réponse immunitaire peut être modulée par une multitude de facteurs intrinsèques ou extrinsèques
- En l'absence d'infection, la quantité de neutrophiles sur la plaie diminue progressivement en quelques jours
- - les neutrophiles adhèrent à la fibrine ou aux croutes et sont éliminés lors des soins
- - les autres sont éliminés par un mécanisme d'apoptose ou en rejoignant la circulation
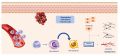
Rôles des monocytes et des macrophages
- Les macrophages jouent un rôle essentiel dans les différentes phases de la cicatrisation
- Ils proviennent de deux sources
- - les macrophages présents naturellement dans le fond de la plaie
- - les macrophages circulant qui proviennent de la moelle osseuse et qui, par diapédèse, se retrouvent également dans le fond de la plaie
- Les monocytes circulants pénètrent en même temps que les neutrophiles dans le lit de la plaie où, en réponse au milieu local, ils se différencient en macrophages.
- Ces cellules présentent une plasticité phénotypique avec alternativement une activité inflammatoire ou anti inflammatoire
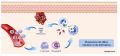
Macrophages de phénotype M1
- Pendant la phase inflammatoire, les macrophages présente une action pro-inflammatoire de type M1 avec production de cytokines (Interleukine 6, Interleukine-1β, Interleukine-12, Interleukine-23 TNF-α).
- Ces cytokines permettent le recrutement de nouveaux polynucléaires avec lesquels ils coopèrent et assurent la phagocytose des débris cellulaires et les pathogènes. Comme les neutrophiles, les macrophages produisent des Métaloprotéases (MMP) qui dégradent la matrice extra cellulaires.
Macrophages de phénotype M2
- Après cette phase de nettoyage de la plaie, les macrophages adoptent un phénotype M2 pour assurer les phases suivante de la cicatrisation → prolifération et remodelage.
- De nombreux signaux permettent le passage du phénotype M1 en M2.
- Pour initier cette nouvelle phase de la cicatrisation, les macrophages M2 produisent des cytokines (Interleukine-10, Interleukine-12 et TGF-β) et des facteurs de croissance (VEGF, PDGF, FGF-2) → ces facteurs de croissance favorisent l'angiogénèse, la prolifération des fibroblastes et des kératinocytes
- Durant cette phase de réparation et de remodelage, les macrophages M2 assurent d'autres rôles
- - ils stimulent la transformation de fibroblastes matures en myofibroblastes qui assurent le dépôt de collagène dans le fond la plaie pour remplacer la fibrine
- - ils régulent la production de MMP et de leurs inhibiteurs, les Inhibiteurs tissulaires des metalloprotéases (TIMPs pour Tissu Inhibitors of Metalloproteinases)permettant de réguler l'homéostasie de la matrice extra cellulaire → formation et dégradation
Phase auto régulée
- La phase inflammatoire s'interrompt progressivement avec la transformation phénotypique des macrophage, la diminution de la quantité de polynucléaires et de macrophages M1 et donc la réduction des cytokines pro-inflammatoires
- A l'issue de cette période, et dans les conditions idéales, la phase de prolifération peut débuter
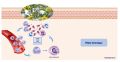
Plaies chroniques
Blocage en phase inflammatoire
- Le processus habituel de la cicatrisation est bloqué au stade inflammatoire avec une inflammation persistante
- La prolongation de la phase inflammatoire entraine un recrutement une activation permanente des cellules inflammatoires → polynucléaires neutrophiles et monocytes
- Le recrutement de ces cellules entraine un déséquilibre dans la sécrétion des protéines
- - augmentation de l'activité protéolytique des MMP, de l'élastase et des collagénases → destruction de la matrice extra cellulaire
- - réduction de et suppression des inhibiteurs des métalloprotéinases (TIMPs)
- - dégradation des facteurs de croissance, des cytokines anti inflammatoires et des composants de la matrice
- Il existe également une augmentation de la postproduction de radicaux libres
Anomalies phénotypiques des macrophages
- De très nombreuses études ont montré que l'évolution chronique d'une plaie est corrélée à une anomalie de transition phénotypique des macrophages[1] [2]
- Alors que dans les conditions normales,les macrophages M1 (pro-inflammatoires) se transforment en macrophage M2 (anti-inflammatoires), dans certaines conditions, on assiste à une persistance du phénotype M1 pro-inflammatoire
- - dans les ulcères veineux, le dépôts ferriques ( hémosidérine) dans le derme favorisent cette persistance
- - chez le diabétique, des études sur la souris on montré que le diabète diminue les capacité d'efférocytose des macrophages M entretenant ainsi un état inflammatoire avec diminution du passage au phénotype M2
- Ces différentes études montrent le rôle central de l'immunité innée et des perturbation dans la chronicité d'une plaie
Rôle de la charge bactérienne et des biofilm
- De nombreux travaux évoquent le rôle du microbiome de la plaie et de la formation de biofilms pour expliquer la chronicité d'une plaie
- Cependant on manque encore de preuve pour comprendre la relation entre d'une part, la composition du microbiome, la formation du biofilm , les anomalies de l'immunité innée et d'autre part l'inflammation chronique persistante qui existe sur la plaie.
- - est-ce que la présence des germes et du biofilm provoquent la dysrégulation de l'immunité innée
- - ou est-ce que les anomalie immunitaires créent un micro environnement qui favorise le développement du biofilm
Références
- ↑ Krzyszczyk P, Schloss R, Palmer A, Berthiaume F. The Role of Macrophages in Acute and Chronic Wound Healing and Interventions to Promote Pro-Wound Healing Phenotypes. Front Physiol (2018) 9:419.
- ↑ Li M, Hou Q, Zhong L, Ahao Y, Fu X. Macrophage related chronic inflammation in non healing wounds. Front Immunol 2021 Jun 16;12:681710